HALUROS DE ALQUILO
- Reconocer y caracterizar halogenuros de alquilo
- Ilustrar una reacción de sustitución nucleofílica
- Aprender cómo obtener un halogenuro de alquilo como el cloruro de t-butilo
II. MARCO TEÓRICO
a. Generalidades
Los compuestos orgánicos se agrupan en familias con bases en los grupos funcionales que los contienen. Dos de las familias más importantes son los alcoholes y halogenuros de alquilo. Estos son útiles en especial porque son materias primas versátiles para preparar otros numerosos grupos de familias.
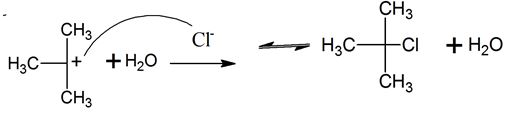
La conversión de alcoholes en halogenuros de alquilo, por reacción de halogenuros de hidrógeno se da como:
R-OH + H-X à R-X + H-OH
Alcohol Halogenuro de hidrógeno Halogenuro de alquilo Agua
Los halogenuros de alquilo permiten la introducción de grupos sustituyentes más variados y a ellos se debe su gran valor como agente de síntesis. Debido a que el enlace C-X (polar), los halogenuros se compartan como electrolitos.
b. Clases de halogenuros de alquilo y alcoholes
Muchas de las propiedades se ven afectadas si sus grupos funcionales están unidos a carbonos primarios, secundarios o terciarios. Los alcoholes y halogenuros de alquilo se clasifican en 1°,2° y 3° con base en el grado de sustitución de carbono que lleva el grupo funcional.
De tipo 1°: RCH2G
De tipo 2°: RCHG
De tipo 3°:R3CG
Tomando que G es el grupo funcional y R el grupo alquilo.
c. Preparación de halogenuros de alquilo a partir de alcoholes y halogenuros de hidrógeno
El orden de reactividad de los halogenuros de alquilo es paralela a su acidez.
HI > HBr > HCl >> HF
Sin embargo HI se usa con poca frecuencia y la reacción con los alcoholes con el fluoruro de hidrógeno no es un método útil.
Entre las diversas clases de alcoholes, se observa que los alcoholes terciarios son los más reactivos.
En minutos los alcoholes 3° se convierten cloruros de alquilo con alto rendimiento al reaccionar con cloruro de hidrogeno a temperatura ambiente e incluso menor.
d. Mecanismo SN1 Y SN2
SN representa la sustitución nucleofilica, seguido por el número 1 o 2 según sea unimolecular o bimolecular. Se dice que la reacción de alcohol ter-butílico con cloruro de hidrógeno, siguen un mecanismo SN1. Debido a que su paso lento (disociación del ion butiloxonio) es unimolecular.
III. MATERIALES
Tubos de ensayo
Gradilla
Ter-butanol
Erlenmeyer
HCL*
Sulfato de sodio anhidro*
IV. PROCEDIMIENTO EXPERIMENTAL
Primero revisamos que todos los materiales estén limpios y listos para usarse, de no ser así, los prepararemos para iniciar el experimento.
En una pera de decantación añadiremos 2 ml de terbutanol y 6ml de ácido clorhídrico y agitamos la mezcla.
Fig.1. Pera de decantación
Fig2. Mezcla agitada
Notamos que se forma más de una fase, descartamos la fase acuosa. La parte orgánica la colocamos en un tubo de ensayo y le añadiremos carbonato de sodio.
V. REACCIONES
Ter-butanol(5 mL) + HCL(concentrado) -> Cloruro de ter-butilo + agua
Mecanismo de reacción
Protonación del atomo más básico Formación del carbocatión
VI. CONCLUSIONES
- Un halogenuro de alquilo se clasifica de acuerdo con el tipo de carbono que sea portador del halógeno.
- Dependiendo del halogenuro de alquilo que se tenga habrá reacciones de reconocimiento
- Los haluros de alquilo tienen el mismo tipo de reacciones
- Todos los haluros de alquilo no tienen la misma velocidad de reacción.
VII. REFERENCIAS BIBLIOGRÁFICAS
- Chang,R y Goldsby, E.Quimica.11vaEd.Mexico: McGrawHill,2013.
- Choquesillo,F.,Canales,C. Manual de prácticas quimica organica.UNMSM. 2014
- Kotz J.C. y Treichel P.M. Química y Reactividad química.Editorial Cengage Learning / Thomson Internacional. 2009. Sexta edición
- Umland J. y Bellama J. Química General. Editorial ITE Latin América. 2004. Tercera Edición.
- Yurkanis , P. Fundamentos de la química orgánica. Edit. Pearson Hall Mexico DF,2011.




Comentarios
Publicar un comentario